Die chronisch obstruktive Lungenerkrankung (COPD) ist eine progrediente Erkrankung. Je früher die Diagnose gestellt wird, desto schneller können geeignete Maßnahmen ergriffen werden, die das Fortschreiten derErkrankung verlangsamen können.
Bei Verdacht auf eine COPD sollte eine Lungenfunktionsprüfung zur weiterführenden Diagnostik erfolgen.1 Laut Prof. Dr. med. Kathrin Kahnert, Fachärztin für Innere Medizin und Pneumologie am MediCenter Germering, werden COPD-typische Veränderungen nicht selten erst spät über eine Spirometrie erkannt. Daher sollte bei unauffälliger Spirometrie aber hochgradigem Verdacht auf eine COPD eine weiterführende fachärztliche Abklärung mittels erweiterter Lungenfunktionsdiagnostik inklusive Bodyplethysmographie und Diffusionskapazität erfolgen.
Der Grad der Obstruktion wird dann anhand der spirometrischen Kriterien in GOLD 1-4 eingeteilt. Die initiale Therapie richtet sich nach Symptomlast und Exazerbationsrisiko, entsprechend der GOLD Gruppen A, B und E (Abb. 1).1
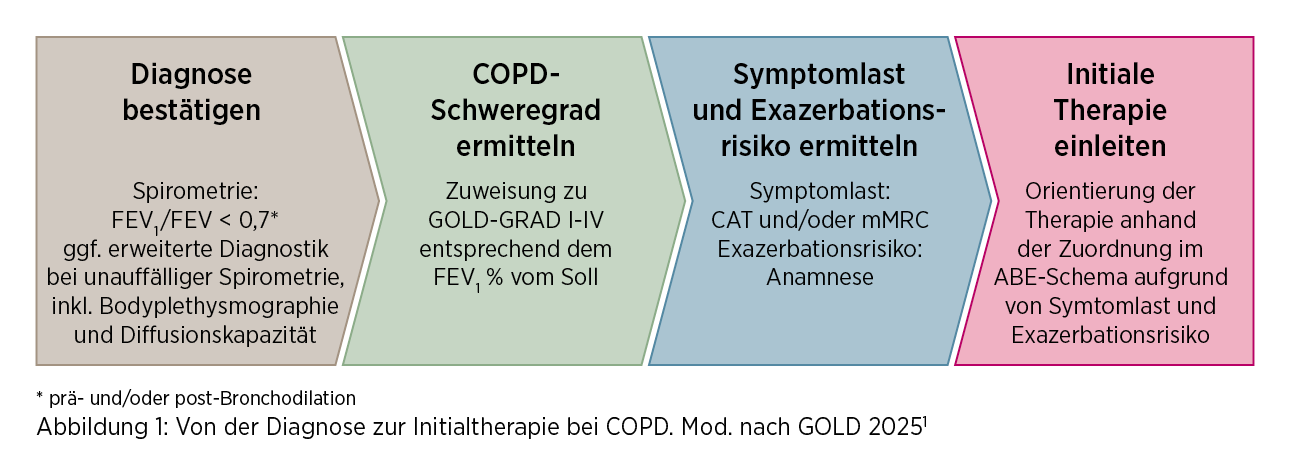
1) Diagnosebestätigung mittels Spirometrie
Bei Patient*innen mit Verdacht auf COPD muss die Diagnose mittels Spirometrie abschließend überprüft werden. Bei einem post-bronchodilatatorischen Tiffeneau-Index (FEV1/FVC) von
< 0,7 gilt die COPD-Diagnose als bestätigt. Bei symptomatischen Patient*innen kann auch die prä-Bronchodilatator-Spirometrie als erster Test auf eine Atemwegsobstruktion verwendet werden.1
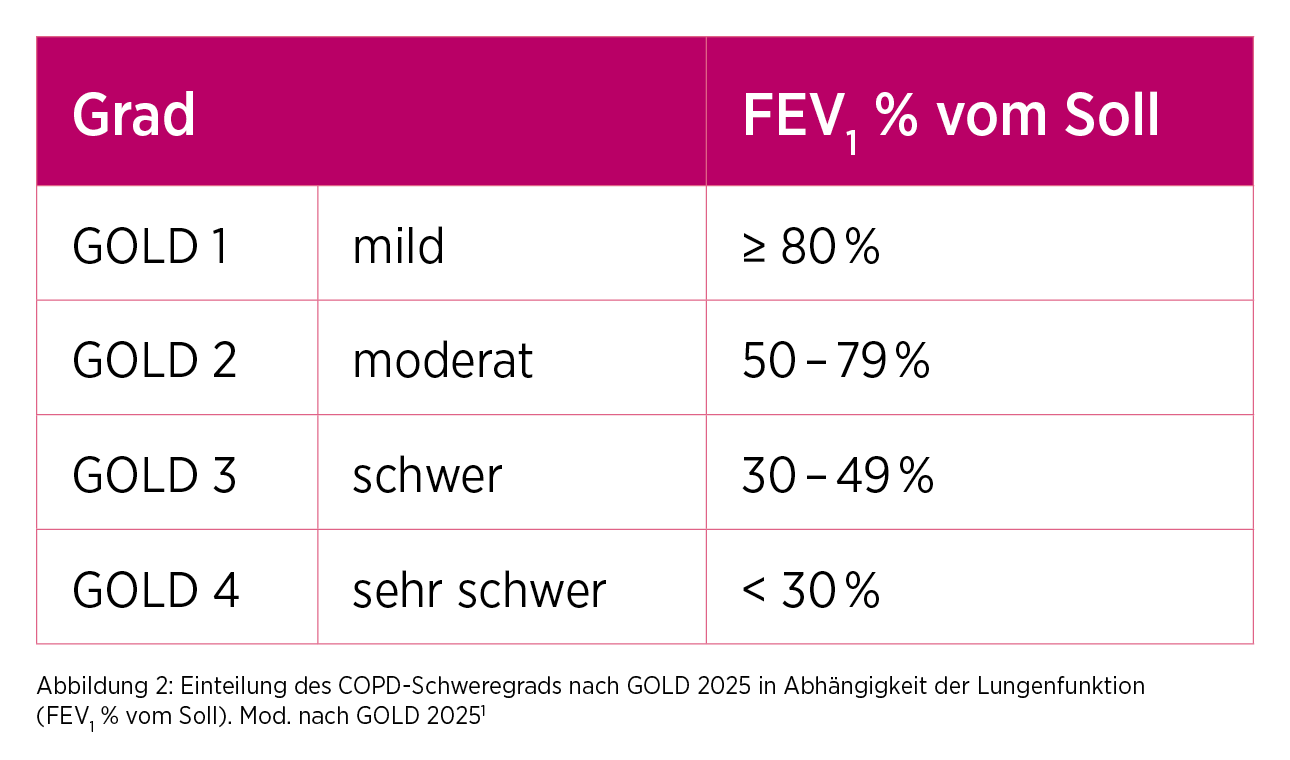
2) GOLD 1,2,3 oder 4? Der COPD-Schweregrad ist abhängig vonder Lungenfunktion
3) Entscheidendfür die initiale Therapie: Symptomlast und Exazerbationshistorie
a. Symptomlast
Die Schwere der Atemwegsobstruktion (COPD-Grad 1-4) korreliert
nur sehr schwach mit dem Ausmaß der Symptome oder der Beeinträchtigung des Gesundheitszustandes der COPD-Patient*innen. Deshalb ist es wichtig, die individuelle Symptomlast mittels validierter Fragebögen zu ermitteln.1
Der COPD Assessment TestTM (CAT) ist ein Patientenfragebogen, der über 8 einfache Fragen zur Symptomatik (Dyspnoe, Husten und Auswurf) und zur Beeinträchtigung des Alltags (Isolation, Schlafqualität und Energielevel) eine Einschätzung der Symptomlast ermöglicht.1 Ab einem CAT-Score von ≥ 10 gilt die Symptomlast als erhöht.
Ein weiterer Patientenfragebogen ist der Modified Medical Research Council Dyspnoe Scale (mMRC), der zur Einschätzung der Dyspnoe entwickelt wurde. Ab einem mMRC-Grad ≥ 2 kann von einer erhöhten Symptomlast (Atemnot) ausgegangen werden.1
Aus dem GOLD-Report 2025:
Besteht eine deutliche Diskrepanz zwischen dem Ausmaß der Atemwegsobstruktion und den wahrgenommenen Symptomen, sollte eine detailliertere Untersuchung durchgeführt werden, um die Lungenmechanik (z. B. vollständige Lungenfunktionstests mit Bodyplethysmographie und Messung der Diffusionskapazität sowie Belastungstests), die Lungenstruktur (z. B. Computertomographie) und/oder Begleiterkrankungen (z. B. ischämische Herzerkrankung), die sich auf die Symptome der Patient*innen auswirken könnten, besser zu verstehen.
b. Exazerbationshistorie
Die leitliniengerechte Therapie hängt stark vom individuellen Exazerbationsrisiko ab. Da die Exazerbationshistorie der stärkste Prädiktor für das zukünftige Exazerbationsrisiko ist, sollte diese bei der Erstdiagnose im Rahmen der Anamnese unbedingt erfasst werden. Bei Patient*innen mit ≥ 2 mittelschweren oder ≥ 1 schweren Exazerbation im Vorjahr wird von einem erhöhten Exazerbationsrisiko ausgegangen.1
Laut GOLD 2025 gibt auch die Bluteosinophilenzahl in Kombination mit der Exazerbationshistorie Aufschluss über die Höhe des Exazerbationsrisikos. Patient*innen mit Bluteosinophilenzahlen ≥ 300 Zellen/µl und einem erhöhten Exazerbationsrisiko können von einer ICS-haltigen Triple-Therapie besonders profitieren.1 GOLD 2025 weist darauf hin, dass Bluteosinophilenzahlen variieren können und als Richtwert gesehen werden sollten.1
4) Zielder initialen Therapie ist eine bestmögliche Krankheitskontrolle
a. Inhalative Therapie
Die initiale Therapie gemäß GOLD 2025 orientiert sich an Symptomlast (nach CAT oder mMRC) und Exazerbationshistorie (Abbildung 3). Im ABE-Schema sollen Patient*innen entweder mit einem inhalativen Bronchodilatator (Gruppe A) oder einer inhalativen Kombinationstherapie aus LABA + LAMA (Gruppe B und E) behandelt werden. Bei Patient*innen in der Gruppe E und Bluteosinophilenzahlen ≥ 300 Zellen/µl sollte der Einsatz einer Triple-Therapie aus ICS+LABA+LAMA* geprüft werden.1,*
Auch die wirksamste Therapie kann nur helfen, wenn sie regelmäßig und korrekt angewendet wird. Prof. Dr. med. Kathrin Kahnert legt in der Praxis einen hohen Stellenwert auf eine ausreichende Therapieadhärenz gleich zu Beginn der Behandlung:

- Je mehr Devices verwendet werden, desto mehr Anwendungsfehler treten auf.2
- Die Anwendung einer Kombinationstherapie mit nur einem einzigen Inhalator kann dabei helfen, die Adhärenz zu erhöhen.1,2 Beispielsweise kann eine fixe inhalative Triple-Therapie den Gesundheitszustand im Vergleich zur Behandlung mit mehreren Inhalatoren verbessern.3
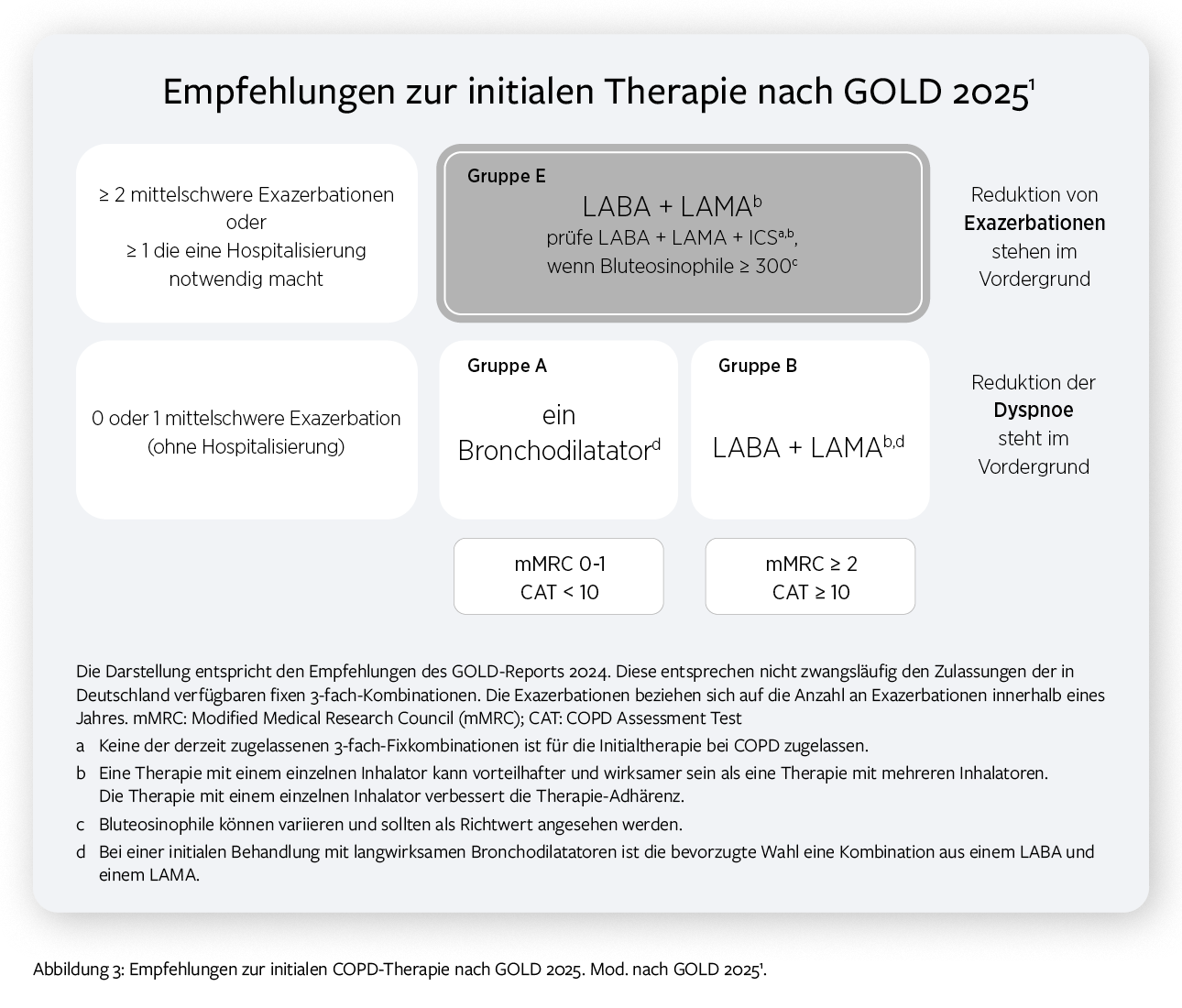
b. Nicht-medikamentöse Interventionen
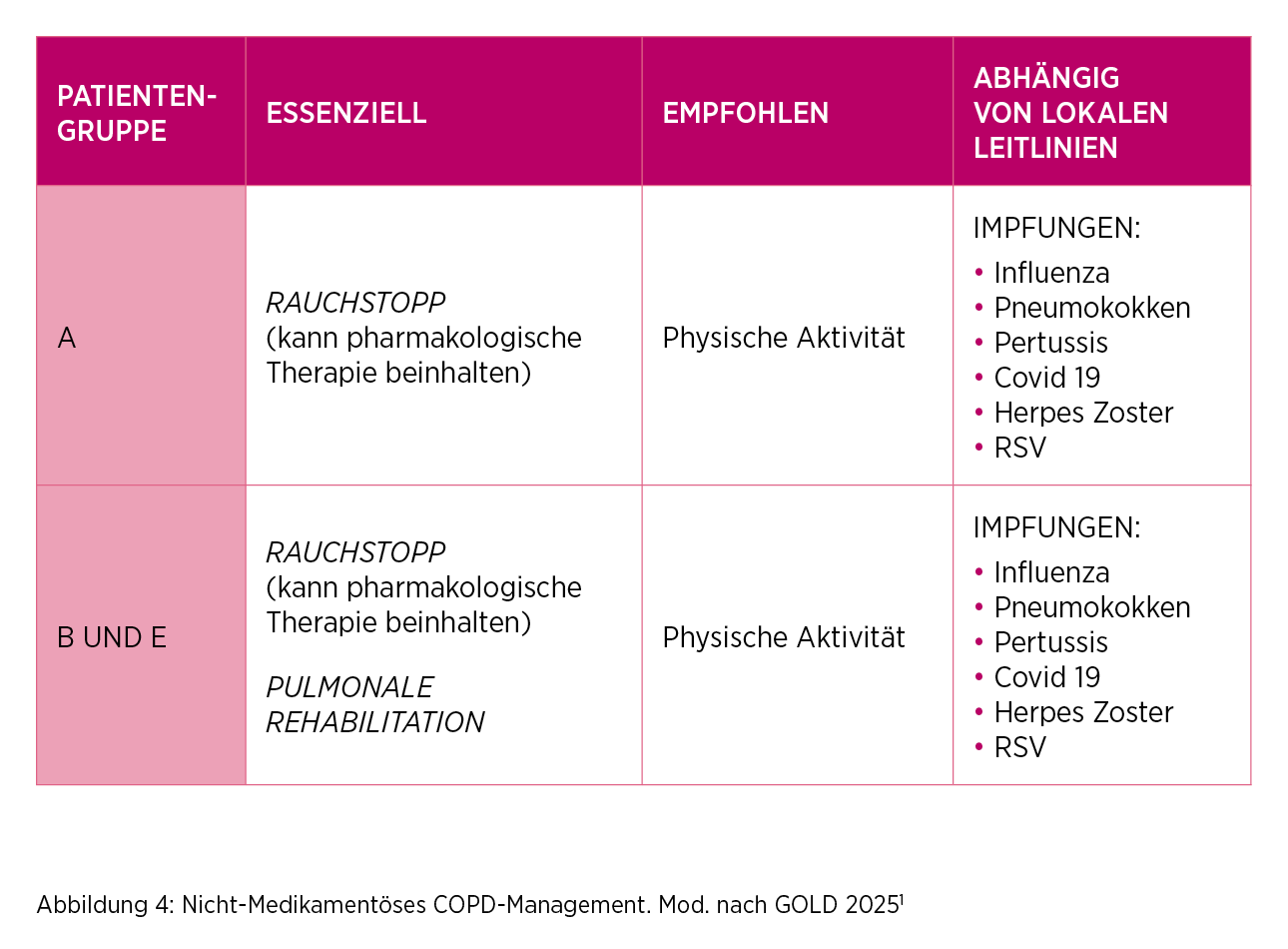
Für alle Patient*innen, unabhängig von der Patientengruppe
nach GOLD, werden neben einer inhalativen Therapie auch nicht-medikamentöse Maßnahmen empfohlen (Abbildung 4).
Generell sollen den Patient*innen zudem ausreichend Informationen und Anleitungen zum Selbstmanagement der Atemnot und zur Stressbewältigung angeboten werden. Darüber hinaus sollen die Patient*innen über mögliche Risikofaktoren aufgeklärt werden und einen schriftlichen Aktionsplan erhalten.1
Da es sich bei COPD um eine lebenslange und progrediente Erkrankung handelt, sollten alle Patient*innen zu einem nachhaltigen gesunden Lebensstil, inkl. einer ausgewogenen
Ernährung und ausreichender Bewegung, motiviert werden. Eine der wichtigsten Maßnahmen ist die Rauchentwöhnung, mit der die Symptomlast und das Exazerbationsrisiko stark gesenkt werden kann. Nikotinersatz, Pharmakotherapie und die Beratung durch Fachkräfte des Gesundheitswesens können hierbei unterstützen.1 In Deutschland stehen auch verordnungsfähige digitale Gesundheitsanwendungen (DiGAs) wie die App NichtraucherHelden als Unterstützung zur Rauchentwöhnung zur Verfügung.4
Der Impfschutz sollte gemäß aktueller STIKO-Empfehlungen aufrechterhalten werden, um Atemwegsinfekten vorzubeugen.5 Zudem wird gemäß dem GOLD-Report 2025 bei Patient*innen mit einer hohen Symptomlast und/oder einem hohen Exazerbationsrisiko (Gruppen B und E) die Teilnahme an einer pulmonalen Rehabilitation empfohlen.1
Nach der Therapieinitiierung ist vor der Verlaufskontrolle!
Fußnoten
* Keine der derzeit zugelassenen 3-fach-Fixkombinationen ist für die Initialtherapie bei COPD zugelassen.
FEV: forciertes exspiratorisches Volumen
FVC: forcierte Vitalkapazität;
ICS: Inhalative Kortikosteroide;
LABA: Langwirksamer Beta-2-Agonist;
LAMA: Langwirksamer Muskarin-Antagonist;
STIKO: Ständige Impfkommission
Referenzen
- Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease. GOLD Report 2025. www.goldcopd.org [Abgerufen am 18. August 2025].
- Sulku J et al. NPJ Prim Care Respir Med. 2021 Feb 9;31(1):5.
- Halpin DMG et al. ERJ Open Res. 2021 Jun 7;7(2):00950-2020.
- Nichtraucherhelden App. https://diga.bfarm.de/de/verzeichnis/01085
[Abgerufen am 18. August 2025]. - Robert Koch-Institut. Empfehlungen der Ständigen Impfkommission (STIKO). Epidemiologisches Bulletin, 4/2024. www.rki.de/epidbull [Abgerufen am 18. August 2025].






Inhalt teilen