Verschiedene Risikofaktoren als Ursache
Die zystische periventrikuläre Leukomalazie (cPVL) ist der stärkste Prädiktor für ein schlechtes neurologisches Outcome bei Frühgeborenen unter 1.000 g sowohl in Bezug auf die Entwicklung einer mittelschweren oder schweren Zerebralparese als auch auf ein spätes mentales Entwicklungsdefizit.¹ Verschiedene Faktoren scheinen ursächlich zu sein.
Laut Neonatalerhebung von 2017 liegt in Deutschland eine PVL-Inzidenz für extrem kleine Frühgeborene unter 1.500 g von 1,33% vor,² wobei Frühgeborene mit einem Gestationsalter von 28 bis 33 Wochen von einer cPVL etwa doppelt so häufig betroffen sind.³⁻⁴ Auch im Dattelner Patientenkollektiv wies nur die Hälfte der von einer cPVL betroffenen Frühgeborenen ein Geburtsgewicht unter 1.500 g auf und das Gestationsalter lag im Median bei 30 Wochen, berichtete Prof. Dr. Claudia Roll.
Das Auftreten einer cPVL ist mit prä-, peri- und postnatalen Infektionen sowie mit Hypokapnie assoziiert.⁵⁻⁶ Als pränataler Risikofaktor für eine cPVL wurde ein frühzeitiger Blasensprung (Premature Preterm Rupture Of Membranes, PPROM) und ein langer Zeitraum zwischen Blasensprung und Geburt identifiziert.⁷
Rotavirus-Infektion als Risikofaktor
Nicht nur bakterielle Infektionen, sondern auch Virusinfektionen scheinen die
Entstehung einer cPVL zu begünstigen. So konnte bereits gezeigt werden – unter anderem von der Arbeitsgruppe um Prof. Dr. Linda de Vries aus Utrecht –, dass das Auftreten von cPVL und diffusen Schädigungen der weißen Substanz im Zusammenhang mit Rotavirus-Infektionen stehen.⁸⁻¹⁰ Grundsätzlich sollten Präventionsmaßnahmen ergriffen werden, um die Ansteckungsgefahr der ungeschützten Frühgeborenen mit Rotaviren zu minimieren. Allerdings wird bislang selten untersucht, ob Schwangere bzw. Mütter eine Rotavirus-Infektion aufweisen. Rotavirus-infizierte Neugeborene sollen identifiziert und insbesondere, wenn neurologische Manifestationen vorliegen, diese nachverfolgt und ein sequenzielles Neuroimaging durchgeführt werden.⁸ Die Rolle prä-, peri- und postnataler Infektionen durch andere Viren ist bislang noch nicht geklärt, berichtete Roll.
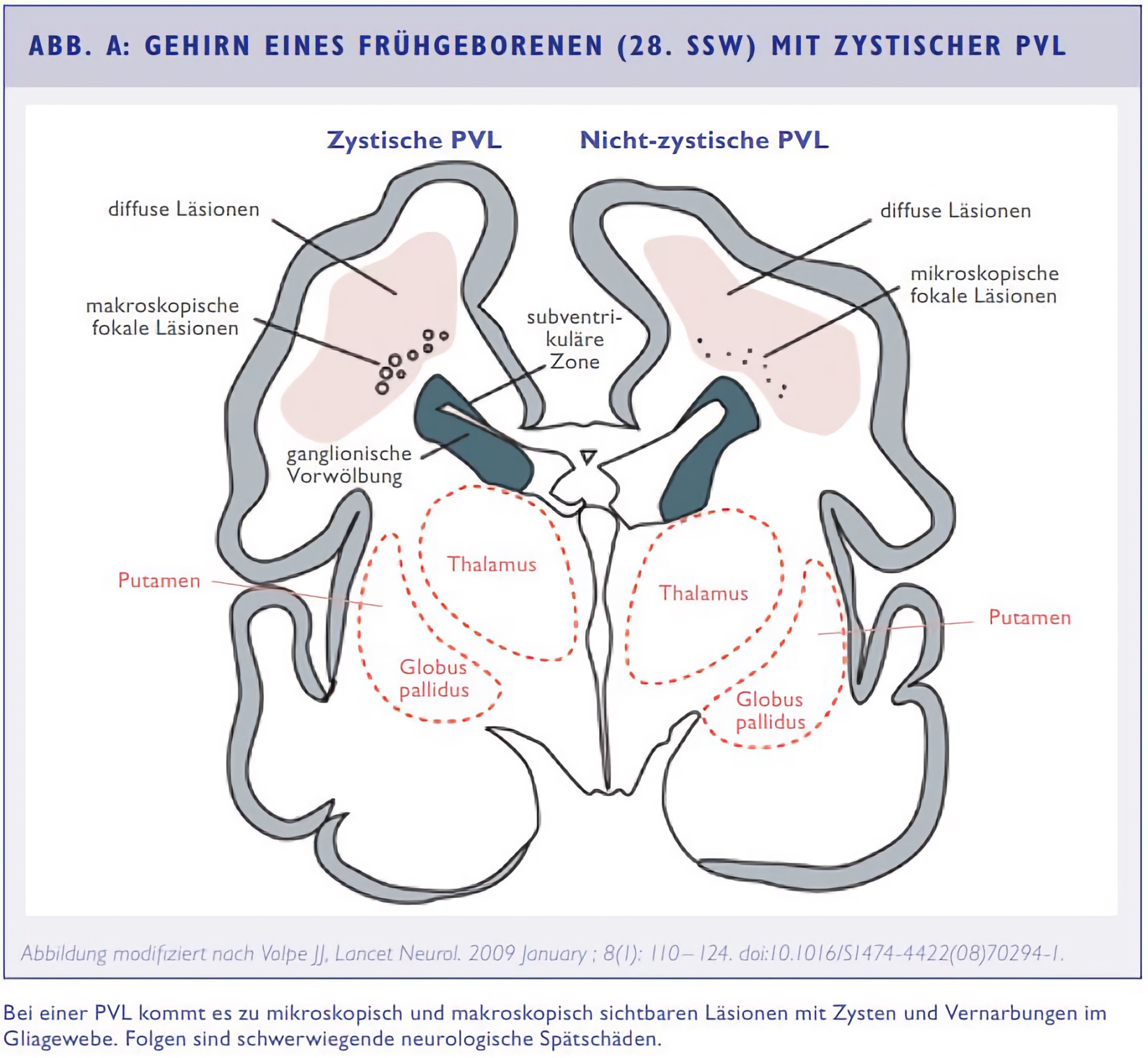
Assoziation von Hypokapnie und zystischer PVL
Das Auftreten der cPVL ist mit einer Hypokapnie assoziiert. Je länger Frühgeborene einem pCO2 < 35 mmHg ausgesetzt sind, desto höher ist das Risiko für die Entwicklung einer PVL.⁵ Beatmete Frühgeborene, die in den ersten drei Lebenstagen eine schwere Hypokapnie (pCO2 < 25 mmHg) entwickelten, zeigten im Vergleich zu den Kontrollkindern deutlich häufiger eine cPVL (19,2% vs. 3,8%) und periventrikuläre Echogenitätserhöhungen (11,5% vs. 1,9%), sogenannte „Flares“.¹¹ Unabhängige Risikofaktoren für die Entwicklung einer Zerebralparese sind neben einem herabgesetzten Kohlendioxid-Partialdruck eine Tokolyse über zehn Tage sowie eine postnatale Gabe von Dexamethason.¹²
Eine japanische Studie verglich beatmete Frühgeborene mit und ohne spätere cPVL in den ersten 72 Lebensstunden. Frühgeborene mit cPVL wiesen im Vergleich zu der Kontrollgruppe signifikant niedrigere pCO2-Werte und höhere pHWerte auf. Die eingestellten Beatmungsparameter unterschieden sich nicht zwischen den Gruppen. Auffällig war, dass die Frühgeborenen, die später eine cPVL entwickelten, eine höhere spontane Atemfrequenz unter Beatmung an Tag 3 und in 91% der Fälle ein pathologisches EEG (Elektroenzephalografie) bereits am ersten Lebenstag zeigten.¹³ Die Autoren stellten die Hypothese auf, dass eine spontane Hyperventilation der Frühgeborenen vorlag und dass die niedrigen pCO2-Werte Ausdruck und nicht Ursache der zugrunde liegenden Störung der sich manifestierenden cPVL sind.
Im eigenen retrospektiv analysierten Patientenkollektiv des Perinatalzentrums Datteln trat eine Hypokapnie in den ersten vier Lebenstagen bei Frühgeborenen mit späterer cPVL unter Beatmung nicht häufiger auf als unter nicht-invasiver Atemunterstützung oder Spontanatmung ohne Atemunterstützung. Die pCO2-Werte unter Spontanatmung waren sogar signifikant niedriger als unter Beatmung und unter nicht-invasiver Atemunterstützung. Sehr tiefe pCO2-Werte in den ersten Lebenstagen sind bei beatmeten Frühgeborenen in einer Reihe unterschiedlicher Studien unabhängig von anderen Variablen mit cPVL bzw. Zerebralparese assoziiert, fasste Roll abschließend zusammen. Kein anderer Parameter weist diese konstante Assoziation mit PVL oder Zerebralparese auf. Die Kausalität und der Mechanismus dieses Befundes müssen jedoch kritisch hinterfragt werden, das zeigen die vorgestellten Ergebnisse.
Referenten der Veranstaltung
Prof. Dr. Claudia Roll, Perinatalzentrum Datteln, Vestische Kinder- und Jugendklinik Datteln, Universität Witten/Herdecke
Prof. Dr. Thomas Höhn, Neonatologie und pädiatrische Intensivmedizin, Heinrich-Heine-Universität Düsseldorf
PD Dr. Angela Kribs, Klinik für Kinder- und Jugendmedizin, Bereich Neonatologie und pädiatrische Intensivmedizin, Uniklinik Köln
Prof. Dr. Ursula Felderhoff-Müser, Klinik für Kinderheilkunde I, Universitätsklinikum Essen
Prof. Dr. Michael Zemlin, Klinik für Allgemeine Pädiatrie und Neonatologie, Universität des Saarlandes Saarbrücken
Dr. Anja Stein, Klinik für Kinderheilkunde I, Universitätsklinikum Essen
Prof. Dr. Linda de Vries, Wilhelmina Children’s Hospital, University
Medical Center Utrecht/Niederlande
Referenzen
- Vohr BR, Wright LL, Poole WK, et al. Neurodevelopmental outcomes of extremely low birth weight infants <32 weeks‘ gestation between 1993 and 1998. Pediatrics 2005; 116(3): 635–43.
- IQTIG. Bundesauswertung zum Erfassungsjahr 2017. Neonatologie. Qualitätsindikatoren. Stand 01.08.2018. 2018. https://iqtig.org/downloads/auswertung/2017/neo/QSKH_NEO_2017_BUAW_V02_2018-08-01.pdf, abgerufen am: 07.02.2019.
- Edstedt Bonamy AK, Zeitlin J, Piedvache A, et al. Wide variation in severe neonatal morbidity among very preterm infants in European regions. 2019; 104(1): F36– F45.
- Natarajan G, Shankaran S, Saha S, et al. Antecedents and outcomes of abnormal cranial imaging in moderately preterm infants. J Pediatr 2018; 195: 66–72.e3.
- Shankaran S, Langer JC, Kazzi SN, et al. Cumulative index of exposure to hypocarbia and hyperoxia as risk factors for periventricular leukomalacia in low birth weight infants. Pediatrics 2006; 118(4): 1654–9.
- Wu YW. Systematic review of chorioamnionitis and cerebral palsy. Ment Retard Dev Disabil Res Rev 2002; 8(1): 25–9.
- Bauer M, Fast C, Haas J, et al. Cystic periventricular leukomalacia in preterm infants: an analysis of obstetric risk factors. Early Hum Dev 2009; 85(3): 163–9.
- Verboon-Maciolek MA, Truttmann AC, Groenendaal F, et al. Development of cystic periventricular leukomalacia in newborn infants after rotavirus infection. J Pediatr 2012; 160(1): 165–8.e1.
- Yeom JS, Kim YS, Seo JH, et al. Distinctive pattern of white matter injury in neonates with rotavirus infection. Neurology 2015; 84(1): 21–7.
- Yeom JS, Park CH. White matter injury following rotavirus infection in neonates: new aspects to a forgotten entity, ‚fifth day fits‘? Korean J Pediatr 2016; 59(7): 285–91.
- Giannakopoulou C, Korakaki E, Manoura A, et al. Significance of hypocarbia in the development of periventricular leukomalacia in preterm infants. Pediatr Int 2004; 46(3): 268–73.
- Takahashi R, Yamada M, Takahashi T, et al. Risk factors for cerebral palsy in preterm infants. Early Hum Dev 2005; 81(6): 545–53.
- Okumura A, Hayakawa F, Kato T, et al. Hypocarbia in preterm infants with periventricular leukomalacia: the relation between hypocarbia and mechanical ventilation. Pediatrics 2001; 107(3): 469–75.





Inhalt teilen