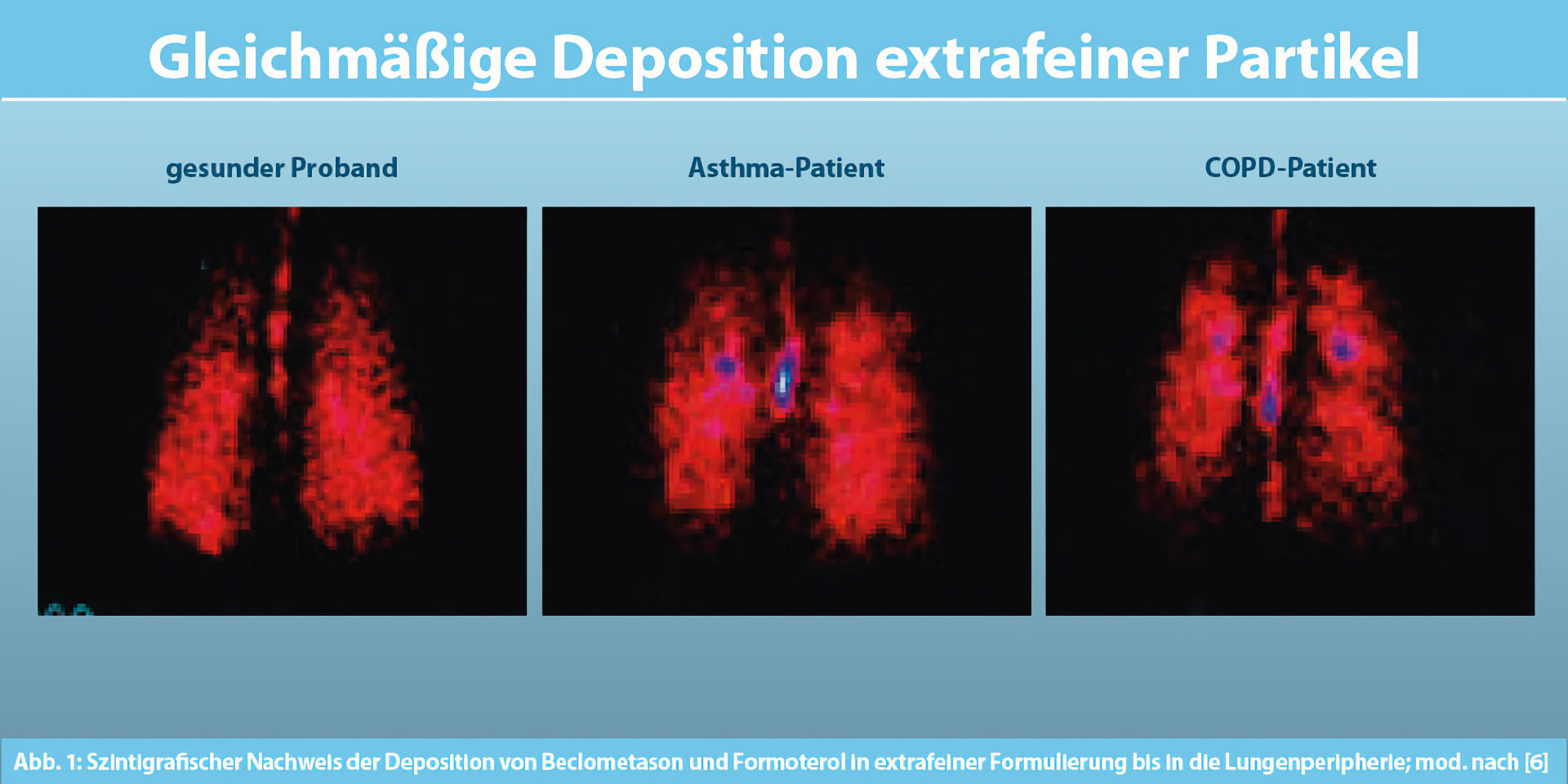
Sowohl bei Asthma als auch bei COPD kommt es zu entzündlichen Prozessen in den peripheren Atemwegen. Daher erscheint es sinnvoll, diesen Bereich der Lunge ebenfalls im Rahmen der medikamentösen Therapie zu adressieren¹. Dabei spielt die Partikelgröße des inhalativen Wirkstoffes eine entscheidende Rolle, um eine Deposition in der gesamten Lunge zu ermöglichen¹.
Entzündung in den kleinen Atemwegen adressieren
Auch wenn sich Asthma und COPD immunpathologisch voneinander unterscheiden, spielen Entzündungsprozesse in den kleinen Atemwegen bei beiden Erkrankungen eine Rolle¹. Die Bedeutung der kleinen Atemwege für die Pathogenese der COPD wird bereits seit längerer Zeit in Expertenkreisen thematisiert². Die inflammatorische Reaktion bei COPD betrifft nicht nur die proximalen sondern auch die distalen Atemwege¹. Es wurde eine Beeinträchtigung der peripheren Atemwege in allen Stadien der COPD nachgewiesen³. Das entzündungsbedingte Remodeling, welches beim Asthma zu einer Reduktion des Bronchiallumens führt, findet ebenfalls sowohl in den großen als auch den kleinen Atemwegen statt und konnte für alle Asthma-Schweregrade nachgewiesen werden⁴. Daher erscheint eine inhalative Therapie, die sowohl bei Asthma als auch bei einer COPD* die Entzündung in den großen und kleinen Atemwegen adressiert, sinnvoll¹.
Partikelgröße entscheidend für den Zugang zu den kleinen Atemwegen
Um auch die peripheren Atemwege zu erreichen, ist u. a. die Partikelgröße des zu inhalierenden Wirkstoffes von Bedeutung. Inhalativa mit einer konventionellen Teilchengröße (> 2 µm) erreichen kaum die distale Lunge. Unterschieden werden extrafeine Partikel und nicht-extrafeine Partikel. Die Einordnung der Partikelgröße richtet sich nach dem MMAD (Mass Median Aerodynamic Diameter), der laut Definition für extrafeine Partikel weniger 2 Mikrometer beträgt. Ein nicht-extrafeiner Partikel hat eine gemittelte Partikelgröße von mehr als zwei Mikrometer Durchmesser⁵. Die Partikelgröße korreliert nachgewiesen mit der Lungendeposition¹.
Therapeutische Erreichbarkeit des gesamten Bronchialbaums
Welche Rolle die therapeutische Erreichbarkeit der gesamten Lunge und die Partikelgröße einer ICS/LABA-Wirkstoffkombination bei der Behandlung von Asthma und COPD spielt, erläutert Prof. Omar Usmani, London:
Extrafeine Partikel ermöglichen gleichmäßige Deposition
Szintigrafische Studien konnten für die extrafeine Fixkombination aus dem inhalativen Kortikosteroid Beclometason (ICS) und dem langwirksamen ß2-Mimetikum Formoterol (LABA) eine hohe und gleichmäßige Deposition in der gesamten Lunge bei Asthmatikern und Patienten mit COPD nachweisen⁶⁻⁷ (Abb.1). Diese extrafeinen Wirkstoffpartikel sind mit einer Größe von circa 1,5 µm nur halb so groß wie die Wirkstoffpartikel anderer nicht-extrafeiner Fixkombinationen (bezogen auf MMAD)⁵.

Extrafeines ICS/LABA: Gleiche Effektivität bei niedrigerer Wirkstoffdosierung
Mit einer extrafeinen Formulierung kann eine hohe und gleichmäßige Deposition der Wirkstoffe in der gesamten Lunge erreicht werden, was sich scheinbar positiv auf die benötigte Wirkstoffdosierung auswirkt⁶⁻⁸. Beispielweise zeigten Singh et al., dass hinsichtlich des morgendlichen prä-Dosis-FEV1 (forced expiratory volume in 1 second) von COPD-Patienten kein signifikanter Unterschied zwischen der Therapie mit Fluticason/Salmeterol (500 µg/50 µg zweimal täglich) oder Beclometason/Formoterol (200 µg/12 µg zweimal täglich) in extrafeiner Formulierung bestand⁸.
In mehreren Studien hat sich die extrafeine Formulierung aus Beclometason und Formoterol im Vergleich mit nicht-extrafeinen ICS-LABA Fixkombinationen als vorteilhaft sowohl für Asthma- als auch COPD-Patienten erwiesen. Die Studienergebnisse befinden sich kompakt zusammengefasst in der folgenden Studienübersicht (Tab. 1).
Vorteile einer extrafeinen Wirkstoffformulierung für Asthma- und COPD-Patienten
| Referenz | Studiendesign | Ergebnisse |
|---|---|---|
| Klinische Studien Crisafulli E et al. Exp Rev Resp Med 2016; 10: 481-490 |
|
|
| De Backer J et al. J Aerosol Med Pulm Drug Deliv 2015; 28: 88-99 |
|
Extrafeines BDP/Formoterol verbessert die Lungenfunktionsparameter und reduziert die Oberblähung. |
| Singh D et al. BMC Pulm Med 2014; 14: 43 |
|
Die FUTURE (Foster Upgrades TherapeUtic care in Respiratory Disease)-Studie ergab innerhalb von zwölf Wochen unter der extrafeinen BDP/Formoterol-Kombination eine klinisch relevante Verbesserung der Lebensqualität", nicht jedoch unter Fluticason/Salmeterol. " Ermittelt mit dem SGRQ; Das primäre Studienziel war der Nachweis der Äquivalenz bei der Behandlungen in Bezug auf den „Transition Dyspnoea Index" (TDI) und der Nachweis der Oberlegenheit von FOSTER® in Bezug auf die Veränderung beim Prä-Dosis FEV in den ersten 30 Minuten. |
| Barnes Net al. Pulm Pharmacol Ther 2013; 26: 555-561 |
|
|
| Corda L et al. Allergy Asthma Proc 2011; 32: 29-34 |
|
|
| Huchon Get al. Respir Med 2009; 103: 41-49 |
|
|
| Real-Life-Studien Price D et al. Prim Care Respir J 2013; 22: 439-448 |
|
|
| Allegra Let al. Respir Med 2012; 106: 205-214 |
|
|
| Terzano Cet al. Respir Res 2012; 13:112 |
|
|
| Müller Vet al. BMC Pulm Med 2011; 11:40 |
|
Signifikante Verbesserung des Asthmakontroll-Scores, im Tagessymptom-Score und bei der Notfallmedikation mit HFA-BDP/Formoterol vs. DPI-BUD/Formoterol und vs. DPI-FP/Salmeterol bei Behandlung > 4 Wochen. |






Inhalt teilen