Geringere Prävalenz kardiovaskulärer Risikofaktoren unter LCP-Tac im ersten Jahr nach LTx verglichen mit ER-Tac
Tacrolimus (Tac) ist der Eckpfeiler der immunsuppressiven Therapie nach Lebertransplantation (LTx). Der Einsatz von Tac hat das Risiko einer akuten Abstoßung erheblich gesenkt und die Kurzzeitergebnisse verbessert, vergleichbare Erfolge bei den Langzeitergebnissen konnten jedoch bisher nicht demonstriert werden.1-3 Hinzu kommt, dass Tac mit einer Vielzahl von Nebenwirkungen in Verbindung gebracht wird, die sich möglicherweise negativ auf die Langzeitergebnisse von LTx-Empfänger*innen auswirken.
Zu den potenziell modifizierbaren Faktoren, die mit Nebenwirkungen assoziiert werden, zählen die kumulative Tac-Exposition und die Tac-Spitzenkonzentration im Blut.4-6 Nephrotoxizität, PTDM, Bluthochdruck und Neurotoxizität sind die häufigsten Nebenwirkungen, die spezifisch mit CNIs in Verbindung gebracht werden, abgesehen von einem erhöhten Infektionsrisiko und der Entwicklung von de-novo-Malignitäten, die für die meisten Immunsuppressiva typisch sind.7
LCP-Tac ist eine Tac-Formulierung mit verlängerter Wirkstofffreisetzung, die eine neue Verabreichungstechnologie (MeltDose®) nutzt.8,9 Diese Formulierung weist im Vergleich zu den anderen verfügbaren Tac-Formulierungen geringere Schwankungen der Spitzenwerte im Blut, sowie eine höhere Bioverfügbarkeit auf, was zu einem geringeren Dosisbedarf führt, um eine definierte Tac-Exposition zu erreichen.8,10,11
Bislang wurde noch kein direkter Vergleich zwischen den beiden einmal täglich verabreichten Tac-Formulierungen (LCP-Tac und ER-Tac) durchgeführt, um die Unterschiede bei klinisch relevanten Endpunkten zu bewerten. Ziel dieser randomisierten, kontrollierten Studie war es daher, zu untersuchen, ob der Einsatz von LCP-Tac im Vergleich zu ER-Tac zu einem Unterschied in der Prävalenz von PTDM, neu auftretender Hypertonie und CKD 12 Monate nach der Transplantation führt.1
Studiendesign
- prospektive Analyse von erwachsenen Patient*innen über 12 Monate, die zwischen April 2019 und Oktober 2021 am Erasmus MC, University Medical Center Rotterdam, Rotterdam, Niederlande oder dem Leiden University Medical Center, Leiden, Niederlande eine primäre LTx erhielten
- 105 Patient*innen wurden bei Entlassung oder innerhalb von 4 Wochen nach der LTx (je nachdem, was zuerst eintrat) von IR-Tac auf LCP-Tac (n=53) oder ER-Tac (n=52) randomisiert
- der primäre Endpunkt war definiert als ein zusammengesetzter Endpunkt mit einem der 3 folgenden Ereignisse: anhaltende (>3 Monate nach der Randomisierung) PTDM, neu auftretende Hypertonie und/oder CKD
Ergebnisse
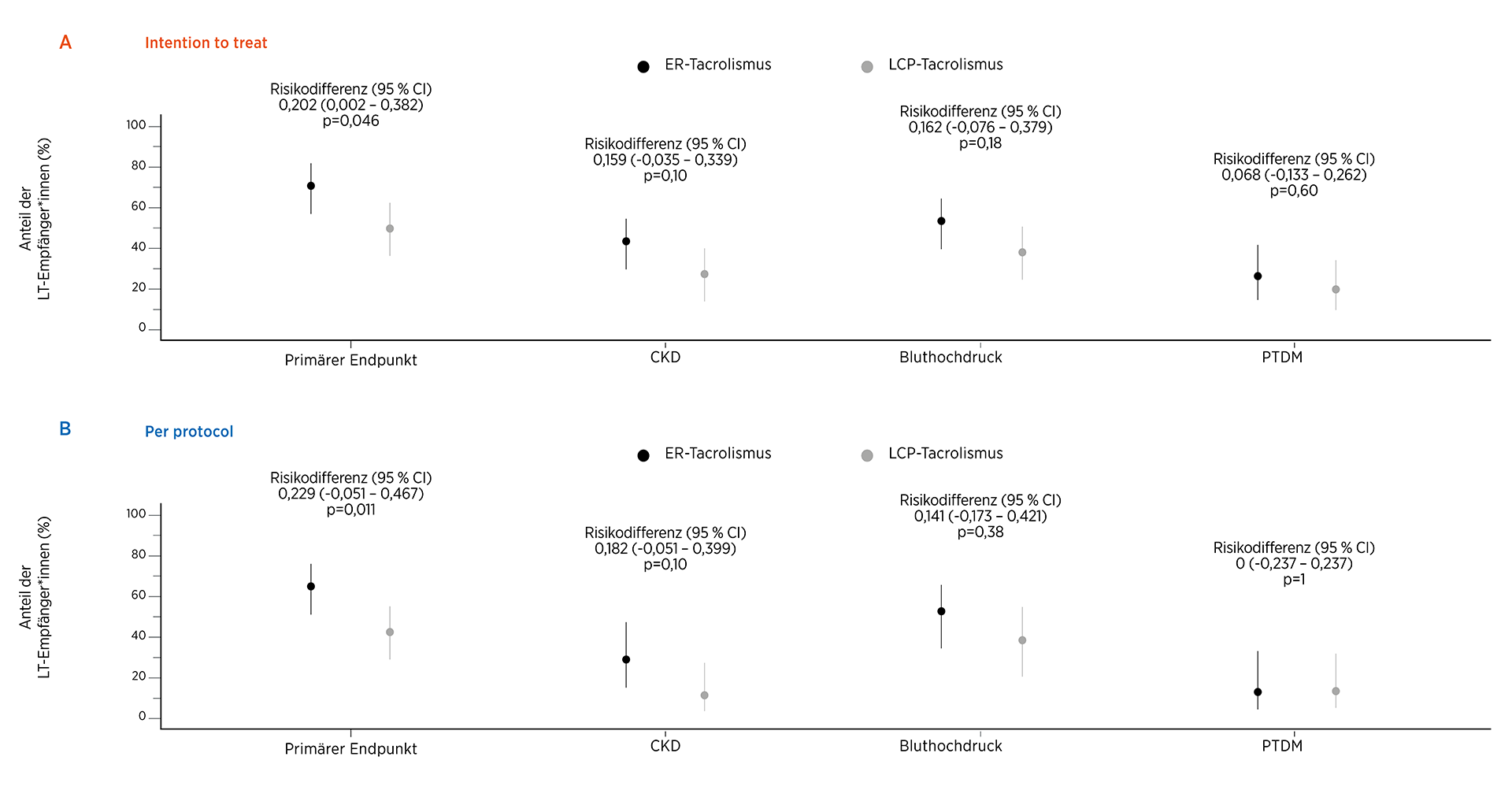
- In der ITT-Population erreichte ein statistisch signifikant geringerer Anteil der LTx-Empfänger*innen in der LCP-Tac Gruppe den kombinierten primären Endpunkt nach 12 Monaten im Vergleich zur ER-Tac Gruppe (50,9 % [27/53]; 95 % KI, 37,9-63,9 % gegenüber 71,2 % [37/52]; 95 % KI, 57,7-81,7 %; Risikodifferenz: 0,202; 95 % KI, 0,002-0,382; p = 0,046) (Abb. 1A)
- In der PP-Analyse war der beobachtete Unterschied statistisch nicht signifikantIn der ITT-Population entwickelten weniger LTx-Empfänger*innen in der LCP-Tac Gruppe eine CKD, neu auftretende Hypertonie und PTDM als in der ER-Tac Gruppe (Abb. 1A)
- In der PP-Population entwickelten weniger LTx-Empfänger*innen in der LCP-Tac Gruppe CKD und neu auftretende Hypertonie als in der ER-Tac Gruppe (Abb. 1B)
- Am Ende der Studie waren in der ITT- und PP-Population die mittleren Tacrolimus-Talspiegel in der LCP-Tac Gruppe statistisch signifikant erhöht, verglichen mit der ER-Tac Gruppe:
- ITT-Population 7,6 ± 3,1 versus 6,3 ± 2,2 μg/L, p = 0,026
- PP-Population 8,3 ± 3,1 versus 6,7 ± 2,1 μg/L, p = 0,033
- Die mediane kumulative Tac-Exposition war nach Monat 12 in der LCP-Tac Gruppe höher als in der ER-Tac Gruppe:
- ITT-Population 2697 μg∙d/L (IQR 2316-2949) versus 2357 μg∙d/L (IQR 1946-2806); p = 0,018
- PP-Population 2707 μg∙d/L (IQR 2383-2975) versus 2612 μg∙d/L (IQR 2219-2976); p = 0,39.
- Nach 6 und 12 Monaten wurden keine Unterschiede in der IPV zwischen den beiden Gruppen festgestellt
- Die Anzahl der Abstoßungsepisoden während der Nachbeobachtung war in beiden Studiengruppen vergleichbar
Fazit
In dieser randomisierten, kontrollierten Studie konnte gezeigt werden, dass in der LCP-Tac Gruppe signifikant weniger LTx-Empfänger*innen den zusammengesetzten primären Endpunkt nach 12 Monaten erreichten verglichen mit der ER-Tac Gruppe, ohne dass dies die Wirksamkeit oder Sicherheit der Therapie negativ beeinflusste.
Die Verwendung von LCP-Tac hatte außerdem einen starken positiven Einfluss auf die CNI-bedingte Nephrotoxizität, da sie zu einer Verringerung der Prävalenz von CKD-Grad ≥3 (eGFR <60 mL/min/1,73 m2) >3 Monate nach LTx um 15,9 %-18,2 % führte. Darüber hinaus lag die Prävalenz des CKD-Grads ≥3 3 und 6 Monate nach der LTx in der LCP-Tac Gruppe bei 15 % bis 17 %, während die Prävalenz in der ER-Tac Gruppe in dieser Studie, wie bereits in früheren Studien beschrieben, zwischen 30 % und 50 % lag.13,14
Die signifikant geringere Prävalenz von neu auftretender Hypertonie in der LCP-Tac Gruppe führen die Autor*innen auf die neue Verabreichungstechnologie mit einer niedrigeren Cmax dieser Tac-Formulierung zurück. Da außerdem die IPV zwischen den Gruppen vergleichbar war, die berechnete kumulative Exposition für LCP-Tac jedoch höher, postulieren die Autor*innen, dass die niedrigere LCP-Tac Spitzenkonzentration im Blut der Faktor ist, der das günstigere kardiovaskuläre Risikoprofil erklärt.
Abkürzungen
CKD = chronic kidney disease
CNI = calcineurin inhibitor
ER = extended-release
ITT = intention to treat
IPV = intra-patient variability
IR = immeditate-release
IQR = Interquartilsrange
KI = Konfidenzintervall
LCP = Life cycle pharma
LTx = Lebertransplantation
PP = per protocol
PTDM = Posttransplantations-Diabetes mellitus
Tac = Tacrolimus
Referenzen
- Todo S, Fung JJ, Starzl TE, et al. Liver, kidney, and thoracic organ transplantation under FK 506. Ann Surg. 1990;212:295–305. Discussion 306.
- Rana A, Ackah RL, Webb GJ, et al. No gains in long-term survival after liver transplantation over the past three decades. Ann Surg. 2019;269:20–27.
- Ruijter BN, Inderson A, van den Berg AP, et al. Randomized trial of ciclosporin with 2-h Monitoring vs. tacrolimus with trough monitoring in liver transplantation: DELTA study. J Clin Transl Hepatol 2023;11:839–849.
- Neuberger JM, Bechstein WO, Kuypers DR, et al. Practical recommendations for long-term management of modifiable risks in kidney and liver transplant recipients: a guidance report and Clinical Checklist by the Consensus on Managing Modifiable Risk in Transplantation (COMMIT) Group. Transplantation. 2017;101(4S Suppl 2):S1–S56.
- Rodriguez-Peralvarez M, Guerrero M, De Luca L, et al. Area under trough concentrations of tacrolimus as a predictor of progressive renal impairment after liver transplantation. Transplantation. 2019;103:2539–2548.
- Rodriguez-Peralvarez M, Colmenero J, Gonzalez A, et al; Chronic Immunosuppression, Cancer Spanish Consortium. Cumulative exposure to tacrolimus and incidence of cancer after liver transplantation. Am J Transplant. 2022;22:1671–1682.
- Watt KD, Pedersen RA, Kremers WK, et al. Evolution of causes and risk factors for mortality post-liver transplant: results of the NIDDK long-term follow-up study. Am J Transplant. 2010;10:1420–1427.
- Tremblay S, Nigro V, Weinberg J, et al. A steady-state head-to-head pharmacokinetic comparison of all FK-506 (tacrolimus) formulations (ASTCOFF): an open-label, prospective, randomized, two-arm, threeperiod crossover study. Am J Transplant. 2017;17:432–442.
- Budde K, Bunnapradist S, Grinyo JM, et al; Envarsus Study Group. Novel once-daily extended-release tacrolimus (LCPT) versus twice-daily tacrolimus in de novo kidney transplants: one-year results of phase III, double-blind, randomized trial. Am J Transplant. 2014;14:2796–2806.
- Garnock-Jones KP. Tacrolimus prolonged release (Envarsus(R)): a review of its use in kidney and liver transplant recipients. Drugs. 2015;75:309–320.
- Staatz CE, Tett SE. Clinical pharmacokinetics of once-daily tacrolimus in solid-organ transplant patients. Clin Pharmacokinet. 2015;54:993–1025.
- Mulder MB, van Hoek B, Polak WG, et al. Modifying Tacrolimus-related Toxicity After Liver Transplantation Comparing Life Cycle Pharma Tacrolimus Versus Extended-released Tacrolimus: A Multicenter, Randomized Controlled Trial. Transplant Direct 2024;12;10(4):e1612.
- Allen AM, Kim WR, Therneau TM, et al. Chronic kidney disease and associated mortality after liver transplantation—a time-dependent analysis using measured glomerular filtration rate. J Hepatol. 2014;61:286–292.
- Mulder MB, van Hoek B, van den Berg AP, et al. Three-year results of renal function in liver transplant recipients on low-dose sirolimus and tacrolimus: a multicenter, randomized, controlled trial. Liver Transpl. 2023;29:184–195.






Inhalt teilen