Die Gabe von Calcineurin-Inhibitoren (CNI) ist essenziell für den Langzeiterhalt von Nierentransplantaten.1,2 Gleichzeitig stellt die CNI-induzierte Nephrotoxizität eine bedeutende Herausforderung in der Transplantationsmedizin dar.1 Tacrolimus, einer der zentralen Vertreter dieser Substanzklasse, erfordert eine sorgfältige individuelle Dosisanpassung, um eine ausreichende Immunsuppression bei minimaler toxischer Belastung sicherzustellen.2
Für die Dosisanpassung ist insbesondere die tatsächliche Bioverfügbarkeit des Wirkstoffs entscheidend. Ein etablierter Parameter zur Abschätzung dieser individuellen Bioverfügbarkeit ist die Konzentration/Dosis-Ratio (C/D-Ratio).2 Eine niedrige C/D-Ratio weist auf eine geringe Bioverfügbarkeit hin und charakterisiert Patient*innen mit schnellem Metabolisierungsprofil (sog. Fast Metabolizer).2 Diese benötigen häufig höhere Tacrolimus-Dosen, was mit einem potenziell erhöhten Risiko für unter anderem nephrotoxische Nebenwirkungen einhergeht.3
Studienaufbau im Überblick: Protect RENvarsus⁴
In der retrospektiven Multi-Center-Studie Protect RENvarsus untersuchten Thölking et al. an 350 Patient*innen nach Nierentransplantation, wie sich eine Umstellung von konventionellem Tacrolimus (IR-Tac) auf Life Cycle Pharma Tacrolimus (LCP-Tac; Envarsus®) auf die Nierenfunktion und die C/D-Ratio über einen Zeitraum von bis zu 60 Monaten auswirkt.
Eingeschlossen wurden Patient*innen ab 18 Jahren, die im ersten Jahr nach Transplantation von IR-Tac auf LCP-Tac umgestellt wurden. Voraussetzung war eine mindestens einmonatige IR-Tac-basierte Therapie in Kombination mit Mycophenolat-Mofetil/Mycophenolsäure (MMF/MPA) oder Everolimus ± Prednisolon.
Primäre Endpunkte der Studie waren die geschätzte glomeruläre Filtrationsrate (eGFR) zu verschiedenen Zeitpunkten (Tag 10, Monat 1, 2, 3, 6, 9, 12, 24, 36, 48 und 60 nach Umstellung), sowohl in der Gesamtpopulation als auch stratifiziert nach Metabolisierungsprofil (Fast vs. Slow Metabolizer). Zu den wichtigsten sekundären Endpunkten zählten u. a. die Inzidenz akuter Abstoßungsreaktionen (BPAR), CMV- und BKV-Infektionen, histologisch gesicherte Tacrolimus-induzierte Nephrotoxizität sowie das Patienten- und Transplantatüberleben.
LCP-Tac – Nierenfunktion nach Umstellung bei Nierentransplantierten⁴
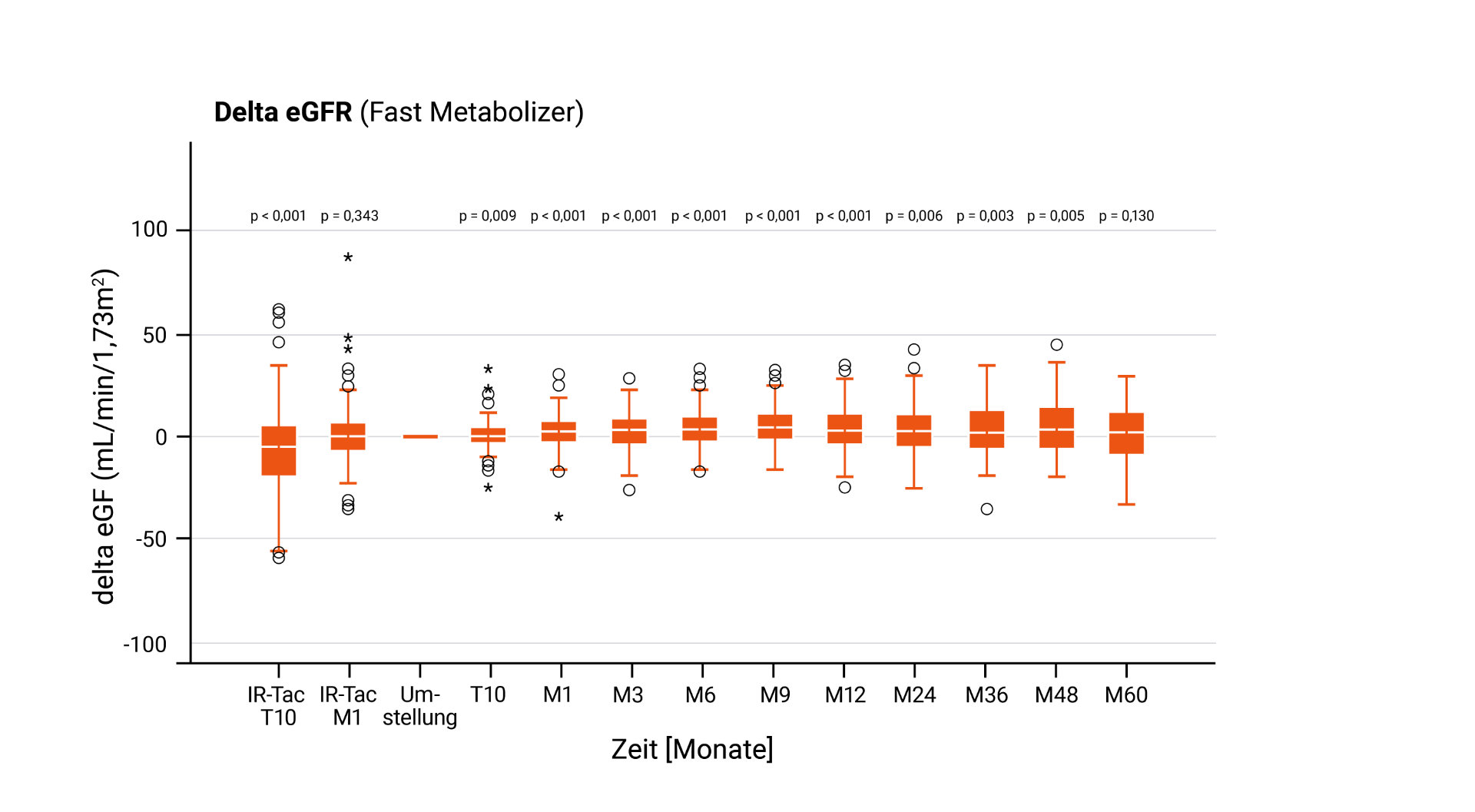
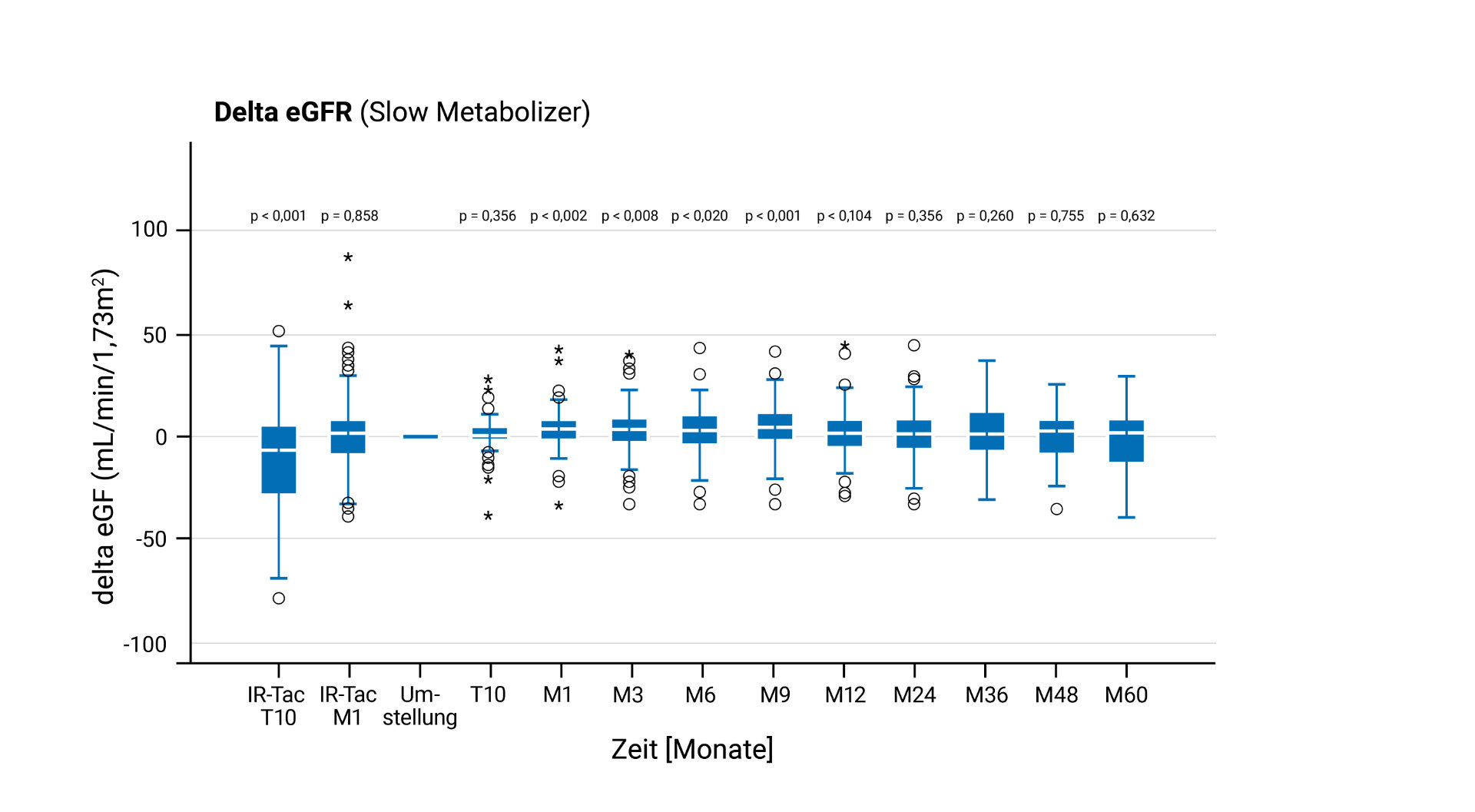
Verbesserung der C/D-Ratio und Reduktion der Tacrolimus-Dosis⁴
Nach Umstellung auf LCP-Tac stieg die durchschnittliche C/D-Ratio bei Fast Metabolizern innerhalb von nur 10 Tagen signifikant an – von 0,66 auf 1,22 ng/ml*1/mg.
Gleichzeitig konnte die erforderliche tägliche Tacrolimus-Dosis deutlich reduziert werden:
- Fast Metabolizer: von 13,0 mg (einen Monat nach Transplantation unter IR-Tac) auf 3,0 mg (nach 60 Monaten unter LCP-Tac)
- Slow Metabolizer: von 7,0 mg auf 2,0 mg im gleichen Zeitraum
Die verbesserte Bioverfügbarkeit für Fast Metabolizer bei gleichzeitig geringerer Dosis könnte auf eine potenziell geringere nephrotoxische Belastung bei gleichbleibender immunsuppressiver Wirksamkeit nach der Umstellung auf LCP-Tac hindeuten.5
Fazit und Ausblick
Die Ergebnisse der Protect RENvarsus-Studie zeigen, dass die Umstellung von IR-Tac auf LCP-Tac bei nierentransplantierten Patient*innen mit einer langfristigen Stabilisierung beziehungsweise Verbesserung der Nierenfunktion verbunden sein kann – vor allem bei Fast Metabolizern.4
Die C/D-Ratio bestätigt sich dabei erneut als praxisrelevanter Marker zur Identifikation von Patient*innen, die besonders von einer Umstellung profitieren könnten. Ein kürzlich von Thölking et al. (2025) vorgeschlagener C/D-Ratio-Cut-off von 1,0 wurde als potenzieller prädiktiver Faktor für die Nierenfunktion untersucht.6 Dieser Cut-off basiert auf der Analyse von 389 Nierentransplantierten und dient dazu, Patient*innen mit schneller bzw. langsamer Tacrolimus-Metabolisierung zu unterscheiden und könnte zukünftig eine wertvolle Rolle bei der individualisierten Immunsuppression in der klinischen Routine spielen.6
Referenzen
- Casey MJ, Meier-Kriesche HU.Curr Opin Nephrol Hypertens. 2011;20(6):610–5.
- Thölking G et al. PLoS One. 2014 23;9(10):e111128.
- Thölking G et al. J Clin Med. 2019 2;8(10):1586.
- Thölking G et al Am J Transplant. 2025;25(8):S427.
- Fontova P et al. Clin Pharmacol Ther. 2021;110(1):238–247.
- Thölking G et al. J Clin Med. 2025 8;14(8):2542.





